Выяснение механизма функционирования целентеразин-зависимых биолюминесцентных белков различных морских светящихся организмов. |
С разрешением 1.72 и 1.3 Å определены кристаллические структуры двух конформационных состояний (до и после реакции) мутанта обелина Y138F. Показано, что замена Tyr ведет к потере молекулы воды в целентеразин-связывающей полости активного фотопротеина. Однако, молекула воды появляется в Са2+-разряженной форме после реакции в той же позиции, что и в соответствующей конформации обелина дикого типа. Из совокупности структурных и биохимических данных сделано заключение, что молекула воды участвует в каталитическом окислении субстрата и формировании первичного эмиттера в биолюминесцентной реакции фотопротеинов.
С разрешением 2.09 и 1.50 Å определены кристаллические структуры двух конформационных состояний (до и после реакции) мутанта обелина F88Y со смещенным в коротковолновую область спектром биолюминесценции. Из анализа водородных связей до и после биолюминесцентной реакции между аминокислотными остатками, расположенными около атома кислорода 6-(п-гидрокси)-фенильной группы целентеразина, сделано заключения, что именно водородные связи, формируемые атомами этих аминокислот и атомом кислорода 6-(п-гидрокси)-фенильной группы определяют различия в спектрах биолюминесценции Са2+-регулируемых фотопротеинов из разных организмов. Исследовано влияние экзогенных соединений (спиртов и ДМСО) на спектры флуоресценции голубого флуоресцентного белка – разряженного фотопротеина обелина. Показано, что увеличение концентрации этих соединений не только уменьшает интенсивность флуоресценции, но и изменяет ее цвет, а именно, уменьшает вклад зеленой компоненты и увеличивает вклад синей. |
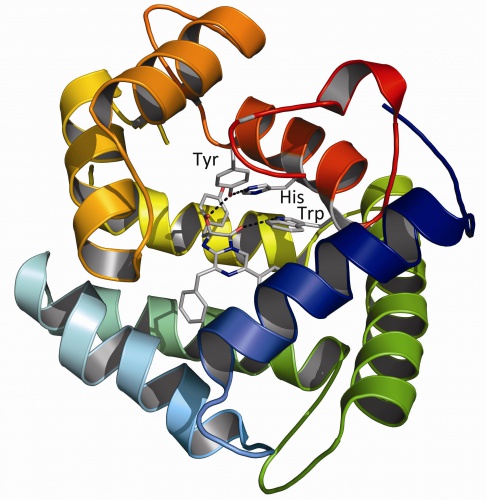
С помощью олигонуклеотид-направленного мутагенеза получены мутантные формы Са2+-регулируемых фотопротеинов обелина из морского гидроида Obelia longissima и акворина из морской гидромедузы Aequorea victoria с заменой аминокислотных остатков, формирующих His-Trp-Tyr триаду (Рисунок) в целентеразин-связывающей полости фотопротеинов, на аминокислоты с различными донорно-акцепторными свойствами боковых цепей.
Рис. Кристаллическая структура Са2+-регулируемого фотопротеина обелина из гидроида Obelia longissima. Молекула субстрата, 2-гидропероксицелентеразина, и аминокислотные остатки, формирующие His-Trp-Tyr триаду, показаны в центре молекулы. На основании результатов исследований физико-химических и биолюминесцентных свойств мутантных фотопротеинов сделано заключение, что аминокислоты, формирующие His-Trp-Tyr триаду, выполняют три основные функции – участвуют в стабилизации и позиционировании 2-гидроперокси производного целентеразина в субстрат-связывающей полости фотопротеинов, в каталитическом окислении субстрата, а также в формировании активного фотопротеина из апобелка, целентеразина и молекулярного кислорода. Eremeeva, E.V., Markova, S.V., Frank, L.A., Visser, A.J., van Berkel, W.J., and Vysotski, E.S. (2013) Bioluminescent and spectroscopic properties of His-Trp-Tyr triad mutants of obelin and aequorin. Photochem Photobiol Sci. DOI: 10.1039/C3PP00002H |